群体感应对三种病原菌致病性的调控机制
群体感应系统由群体感应信号分子、受体和调控蛋白组成。群体感应信号分子是细菌群体感应过程的起始信号分子,由细菌合成并释放到细胞外,群体感应信号分子的浓度随细菌密度的增加而增加。当信号分子浓度达到一定的阈值时,群体感应信号分子,能启动菌体中相关基因的表达,调控细菌的行为,来适应环境的变化。群体感应信号分子与细胞内或细胞膜上相应的受体分子结合后,通过下游的调控蛋白或直接调控相关基因的表达。
致病菌侵入、定殖到宿主体内,产生各种毒力因子,导致宿主发病,这些毒力因子包括分泌到胞外的的蛋白酶类、特定的细胞毒素。此外,许多病原菌都能产生特定的黏附因子,比如鞭毛和外膜蛋白等,它们非特异或特异地结合在宿主的特定部位,定殖下来为进一步危害宿主做准备。最后,病原菌形成对外界各种不良环境的抗性来保护自身,在宿主体内形成生物被膜,抵抗宿主的免疫和介导对药物的抗性。众多病原菌的致病基因受到群体感应的调控,以下对铜绿假单胞菌、金黄色葡萄球菌和大肠杆菌这三种常见病原菌中群体感应系统对细菌毒性产生的调控机制做一简述。
1.1 铜绿假单胞菌
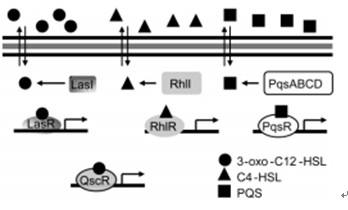
铜绿假单胞菌是一种常见的G-致病菌,是引起病人在住院期间发生感染的三大致病菌之一。如图1所示,铜绿假单胞菌的群体感应系统主要有基于N-酰基高丝氨酸内酯(AHL)为信号分子的las和rhl系统以及喹诺酮(PQS)为信号分子的调控系统组成。
图1 铜绿假单胞菌与细胞毒性相关的群体感应调控
在las系统中,由las I编码的酶Las I合成的信号分子N-3-氧十二酰基高丝氨酸内酯(3-oxo-C12-HSL)与胞浆受体蛋白LasR结合形成AHL-LasR复合体,与相应的靶基因DNA启动子区域结合,激活一系列毒力基因如弹性蛋白酶和碱性蛋白酶等基因的表达,同时促进信号分子3-oxo-C12-HSL的合成,形成一个正反馈调节。
在rhl系统中,由rhl I编码的酶Rhl I合成的信号分子正丁基高丝氨酸内酯(C4-HSL)与胞浆受体蛋白RhlR结合形成AHL-RhlR复合体,激活其他一些毒力因子如绿脓毒素、鼠李糖脂、氢氰酸、弹性蛋白酶等的产生,同时也能促进C4-HSL的合成,形成一个正反馈调节。
las系统中AHL-RhlR复合体可以在转录和翻译后水平控制rhl系统,也就是控制rhlI和rhl R基因的表达。此外,受体蛋白QscR可以感应信号分子3-oxo-C12-HSL从而调控氢氰酸、弹性蛋白酶和细菌运动性相关基因的的表达。
PQS信号系统是以2-庚基-3-羟基-4-喹诺酮(PQS)为信号分子的群体感应调控系统。pqsABCD基因编码的产物合成PQS的前体2-庚基-4-喹诺酮(HHQ),然后由受las系统调控的PqsH将其转变为PQS。HHQ或PQS都可以结合PqsR受体形成复合体并活化,正调控毒力因子的表达,如弹性蛋白酶、绿脓菌素和凝集素的表达的等。PqsR的活化能够调控pqs操纵子,促进信号分子PQS的合成,形成一个正反馈调节,同时PqsR本身也受到las系统的正调控。
1.2 金黄色葡萄球菌
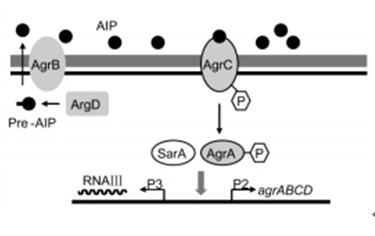
金黄色葡萄球菌是一种危害极大的G+条件致病菌,目前该菌群体感应系统研究较多的主要是基于自体诱导肽(AIP)为信号分子的agr系统,如下图2所示。
图2 金黄色葡萄球菌与细胞毒性相关的群体感应调控
AIP前体(pre-AIP)由agrD基因编码,通过胞膜蛋白AgrB加工成熟为AIP并分泌至细胞外。膜受体组氨酸蛋白激酶AgrC与AIP结合后自身被磷酸化并活化,进一步磷酸化并活化AgrA,AgrA结合到P2和P3启动子区域。P2启动转录的RNA II序列包含agrA,agrB,agrC和agrD四种基因,分别编码AgrA、AgrB、AgrC、AgrD四种蛋白,形成一个正反馈调节。P3启动转录的RNAIII序列,具有正的或负的调控功能,是agr系统的主要的效应分子。RNAIII发挥调控功能的主要机制是通过与目标mRNA碱基配对,来增强或抑制其翻译水平。RNA III不仅编码外毒素如δ-毒素,还可以激活α-溶血素、肠毒素B、C、D的表达,下调黏附素的表达和蛋白A的表达。除此之外,sarA操纵子编码的SarA蛋白可与agr P2和P3启动子结合,提高RNAII和RNA III的转录水平,最终间接影响毒力因子的合成。
1.3 大肠杆菌
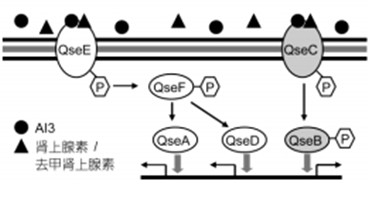
大肠杆菌也是一种条件致病菌。肠出血性大肠杆菌(EHEC)和肠致病性大肠杆菌(EPEC)两者引起的特征性的组织学病变为:肠上皮细胞纹状缘微绒毛变性、消失,细胞骨架结构发生重排形成柱脚样结构,即附着擦抹性损害(A/E损害)。对EHEC和EPEC的研究表明,luxS控制由肠上皮细胞擦抹基因座致病岛编码的III型分泌系统(TTSS)的表达,使效应器蛋白移位至上皮细胞,导致特异性A/E损害。luxS负责合成AI-2,但是后者并没有参与luxS对肠上皮细胞擦抹基因座的调控,后来人们发现一种新的信号分子AI-3参与了群体感应介导的肠上皮细胞擦抹基因座的调控。如下图3所示,LuxS/AI-3群体感应系统调控了EHEC的TTSS、鞭毛、泳动力及其毒力基因的表达,该调控中存在级联反应,至少有6种由qse基因编码的调控因子参与。
图3 大肠杆菌与细胞毒性相关的群体感应调控
细胞外膜受体QseC或QseE结合AI-3和肾上腺素或去甲肾上腺素后,通过两种主要的双组份系统QseCB及QseEF发挥作用。比如,QseC感应信号分子并磷酸化而活化,进一步使QseB磷酸化,QseB与flhDC启动子结合激活鞭毛调节器表达,QseB也可以与自身启动子结合正调控自身的转录。QseE感应信号分子后可激活肠上皮细胞擦抹基因的表达,导致A/E损害。QseF控制细菌效应器蛋白EspFu的转录,该蛋白能诱导细菌黏附所需要的肌动蛋白几座的形成。此外,qse操纵子中的qseG编码一个外膜蛋白,参与III型分泌系统效应器蛋白移位到宿主细胞过程。这种AI-3依赖的群体感应信号传递级联反应可见于肠杆菌中绝大多数细菌,如沙门菌、耶尔森菌、志贺菌等。
群体感应的基本特征就是细菌的密度越大,信号分子的密度就越大,细胞间交流的机会就越多。某种程度上可以说,致病菌感染后个体病程、病情的差异就是由于信号分子水平的差异导致的群体感应活性及其调控的基因表达的不同所致。随着致病菌群体感应研究的不断深入,必将出现致病菌毒力机制的新观点,产生与致病菌斗争的新策略。